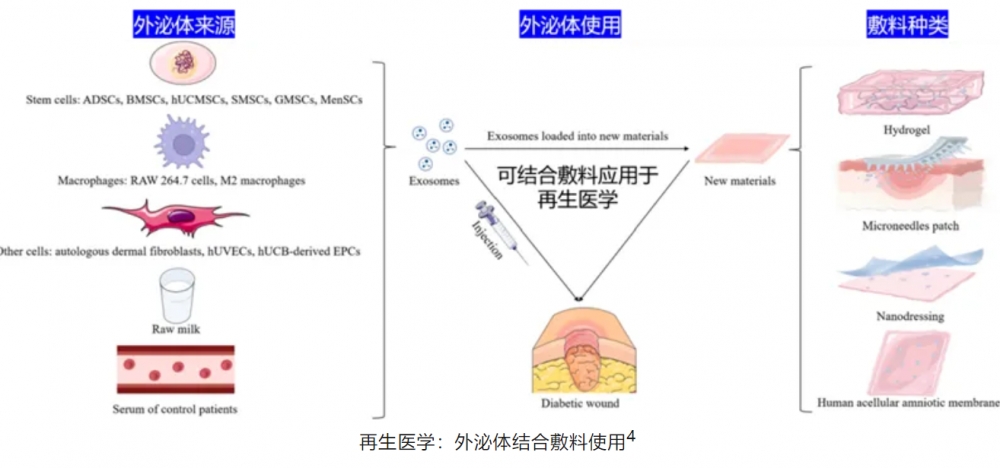
外泌体,作为细胞自然释放的纳米级囊泡,其尺寸范围大致在30纳米至150纳米之间,这些微小的载体富含多种生物活性成分,如蛋白质、脂质、mRNA片段及miRNA等,它们能够在细胞间传递关键信息,并调节目标细胞的生理活动1。
诺贝尔奖委员会将这一过程比喻为:人体犹如繁忙而巨大的"港口",将货物准时准点地运送到指定位置,从而维持其他地区的正常运转。在创伤修复与再生医学的领域中,源自干细胞的外泌体具有显著的促进皮肤再生的能力,这一效应可能归因于其所承载的细胞因子及调控信号分子的作用,其原理虽然还没有完全阐明,但与激活皮肤细胞再生潜能、加速新血管形成、抑制炎症反应有强相关性。
伤口愈合是一个动态且协调的过程,涵盖了四个相互重叠的阶段:止血阶段、炎症阶段,增殖阶段、重塑阶段1。通过测序分析的研究揭示,源自间充质干细胞的外泌体含有高达2000种蛋白质/肽类2,其中不乏各类胶原蛋白。将外泌体局部注射到小鼠皮肤伤口处,研究结果显示伤口闭合过程和胶原蛋白沉积的速度加快了近30%。体外实验进一步证实,HUVECs(人脐静脉内皮细胞)内吞了外泌体,这促进了HUVECs的增殖、迁移和管状形成3。无论是体内还是体外实验,均提示外泌体并非仅参与伤口恢复的单一环节,而是对整个愈合过程进行了全方位的积极调节。

外泌体的引入使得组织再生由人体的自然恢复过程转变为外源性的积极修复,与传统单一生长因子相比,其副作用可能更为安全可控,现有的大量临床试验研究中,几乎不会出现高浓度表皮生长因子(EGF)所导致的瘢痕增生现象。另外,在医疗美容领域,外泌体的应用不仅限于传统美容手术后的护理程序,而且有望基于外泌体开发出全新的美容治疗方案。
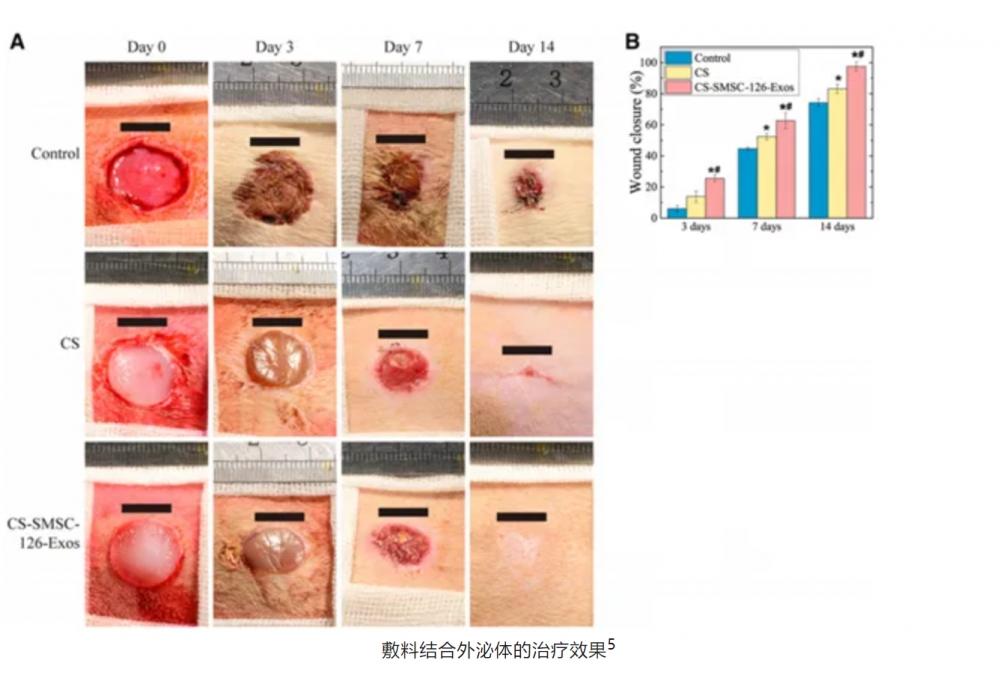
在一项临床前研究中,研究者们观察了使用壳聚糖(CS,常见的敷料材料)或过表达miR-126-3p的滑膜源性间充质干细胞外泌体(SMSC-126-Exos)结合壳聚糖处理的伤口愈合情况。结果显示与对照组相比,CS或CS-SMSC-126-Exos处理的伤口在14天后显示出显著增加的新生表皮长度。此外,CS或CS-SMSC-126-Exos处理的伤口在7天和14天后胶原蛋白沉积明显,实验组处理的伤口愈合明显更快且具有显著性。这些结果均表明,间充质干细胞外泌体结合传统敷料能够更好地帮助伤口愈合5。
在科学研究和医学领域,外泌体这类细胞衍生物的冻干保存技术已在药物研发、细胞治疗等多个领域得到广泛应用。鉴于细胞衍生物中的生物活性成分通常具有复杂的结构且对环境因素极为敏感,冻干技术能够最大程度地保持其生物活性和结构完整性,利于常温或冷藏环境保存。细胞外囊泡(外泌体)由脂质双分子层构成,其中包含的活性物质主要由蛋白质、肽类、脂质组成,相较于-20℃冷冻保存,冻干保存可以减少细胞衍生物的失活;相较于-80℃冷冻保存,具有明显运输和成本优势6。

据市场研究领域的权威机构预测,全球医疗美容市场将从2024年的254.8亿美元规模,显著扩张至2032年的678.9亿美元,其中原本就占据细分市场中最大份额的皮肤修复与抗衰老板块,势必会展现出最为强劲的增长势头。外泌体敷料作为这一领域的重要下游产品,其生物学性能和安全性为皮肤修复及术后护理领域开辟了新途径。此外,外泌体作为一种具有革命性的皮肤再生材料,在医疗美容行业的商业潜力正逐渐显现,国内关于外泌体敷料的专利申请数量已达到59项。在化妆品行业,美国、韩国、日本、中国台湾也相继开放了人源原材料作为化妆品的可添加原料,在香港的购物平台HKTV mall上可以买到部分由人源间充质干细胞培养上清液或外泌体研制出的面膜/精华液产品。


随着细胞与基因治疗产业的不断发展和成熟,国内至少有14家企业正在完善外泌体产业的上、中游商业化技术,为外泌体产业奠定了商业化基础7。通过对供体细胞和外泌体的工程化技术应用,外泌体有望同时实现标准化和个性化定制,以满足不同行业、不同消费者的具体需求。基于外泌体的创新性应用,无疑将为医疗美容行业注入新的生机。1.Tao, S.-C., Guo, S.-C., Li, M., Ke, Q.-F.,
Guo, Y.-P., & Zhang, C.-Q. (2017). Chitosan Wound Dressings Incorporating
Exosomes Derived from MicroRNA-126-Overexpressing Synovium Mesenchymal Stem
Cells Provide Sustained Release of Exosomes and Heal Full-Thickness Skin
Defects in a Diabetic Rat Model. Stem
Cells Translational Medicine, 6(3), 736-747.
2.Qiao, Z., Wang, X., Zhao, H., Deng, Y.,
Zeng, W., Yang, K., . . . Chen, Y. (2023). The effectiveness of cell-derived
exosome therapy for diabetic wound: A systematic review and meta-analysis. Ageing Research Reviews, 85.
3.Qiu, G., Zheng, G., Ge, M., Wang, J.,
Huang, R., Shu, Q., & Xu, J. (2019). Functional proteins of mesenchymal
stem cell-derived extracellular vesicles. Stem
Cell Research & Therapy, 10(1).
4.Safari, B., Aghazadeh, M., Davaran, S.,
& Roshangar, L. (2022). Exosome-loaded hydrogels: A new cell-free
therapeutic approach for skin regeneration. European
Journal of Pharmaceutics and Biopharmaceutics, 171, 50-59.
5.Zhang, Z., Mi, T., Jin, L., Li, M.,
Zhanghuang, C., Wang, J., . . . He, D. (2022). Comprehensive proteomic analysis
of exosome mimetic vesicles and exosomes derived from human umbilical cord
mesenchymal stem cells. Stem Cell
Research & Therapy, 13(1).
6.Charoenviriyakul,
C., Takahashi, Y., Nishikawa, M., & Takakura, Y. (2018). Preservation of
exosomes at room temperature using lyophilization. Int J Pharm, 553(1-2),
1-7.
7.2023年外泌体行业研究报告,作者:郭允乐 贾心语。
声明 | 文章版权归华大细胞所有,仅用于科普,不构成任何医疗建议。未经授权, 禁止转载。感谢 | 做有温度的细胞行业科普,欢迎关注【华大细胞】各自媒体平台。








