
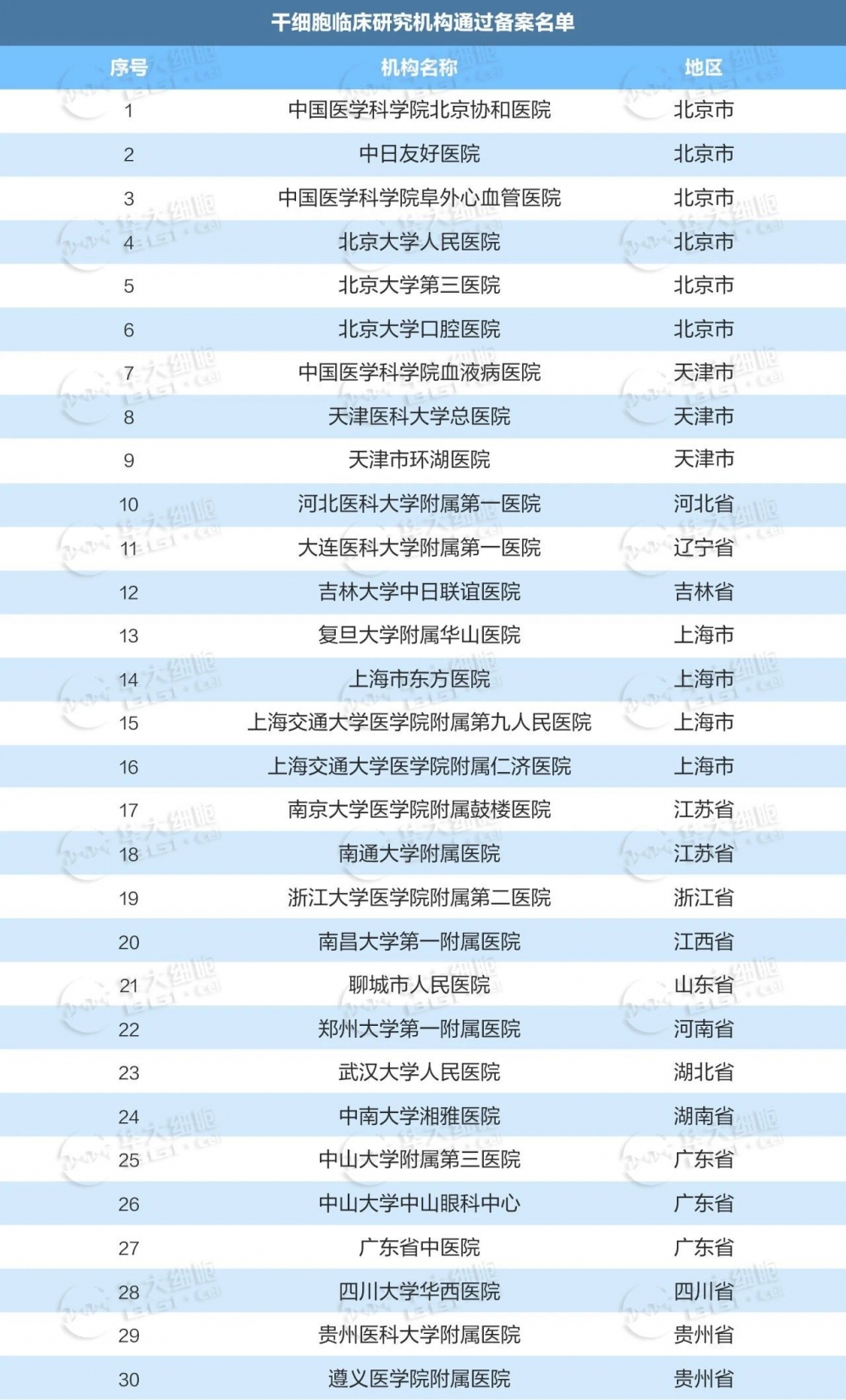
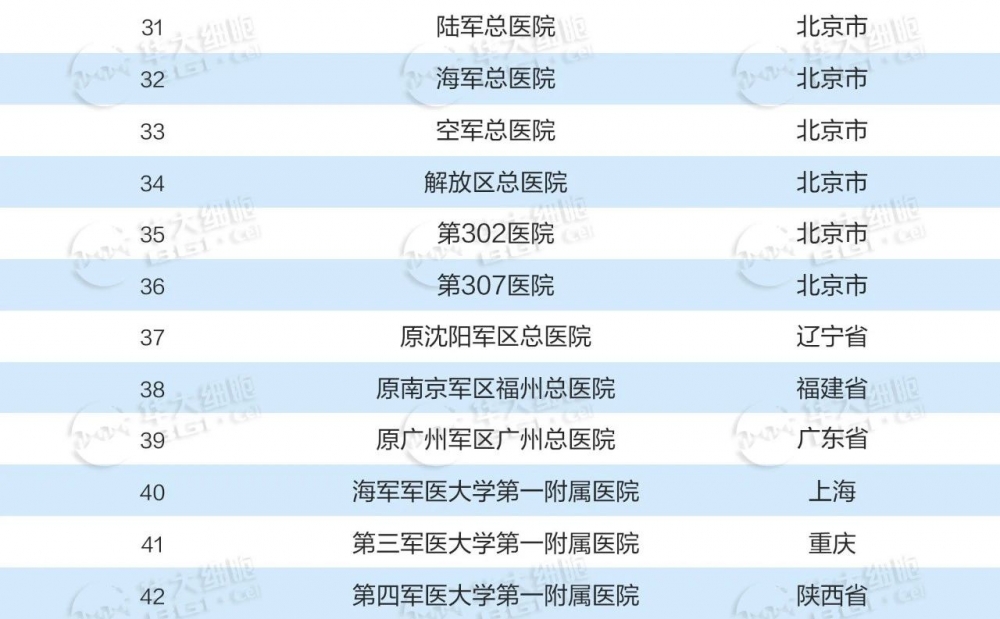
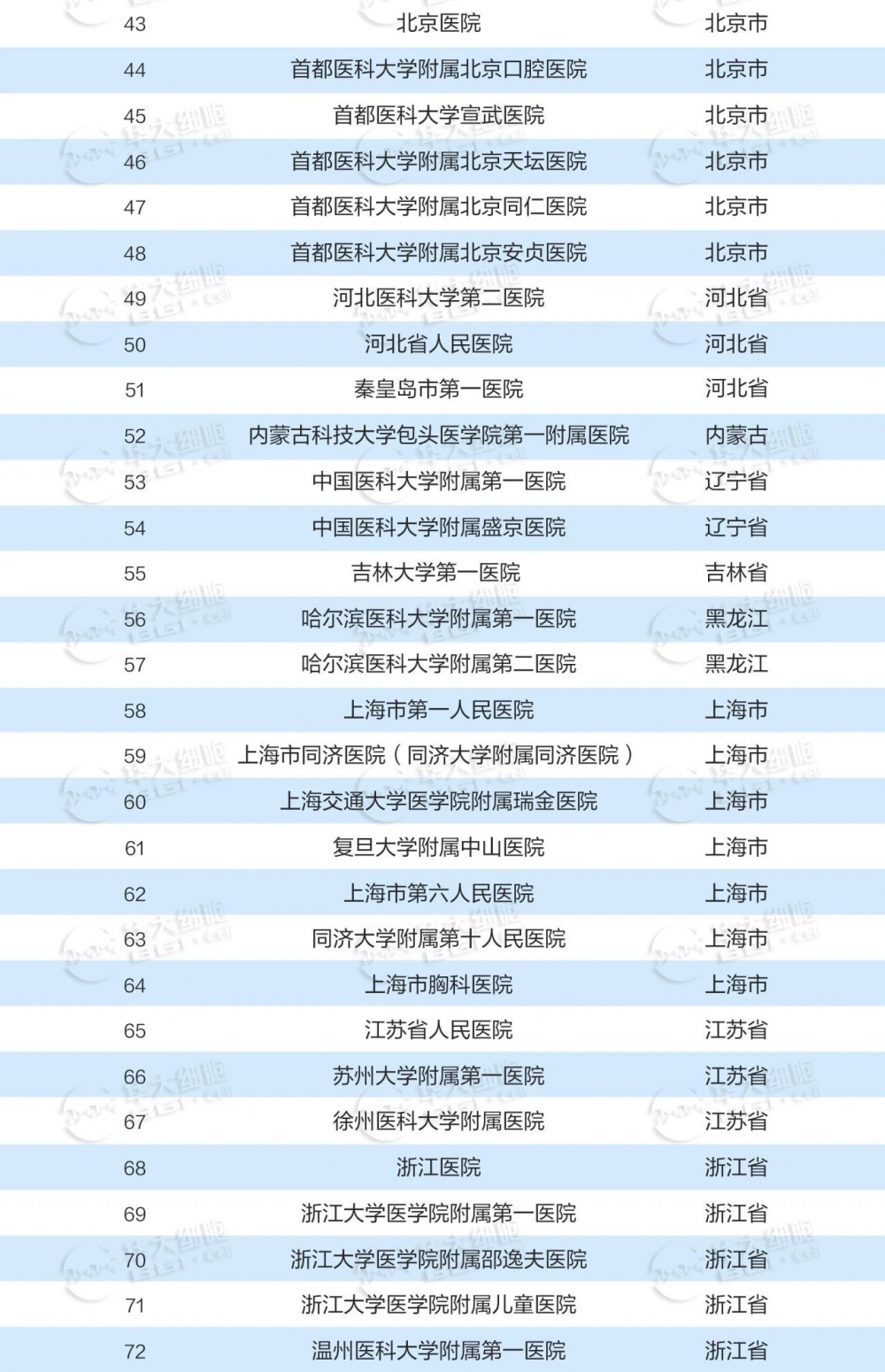
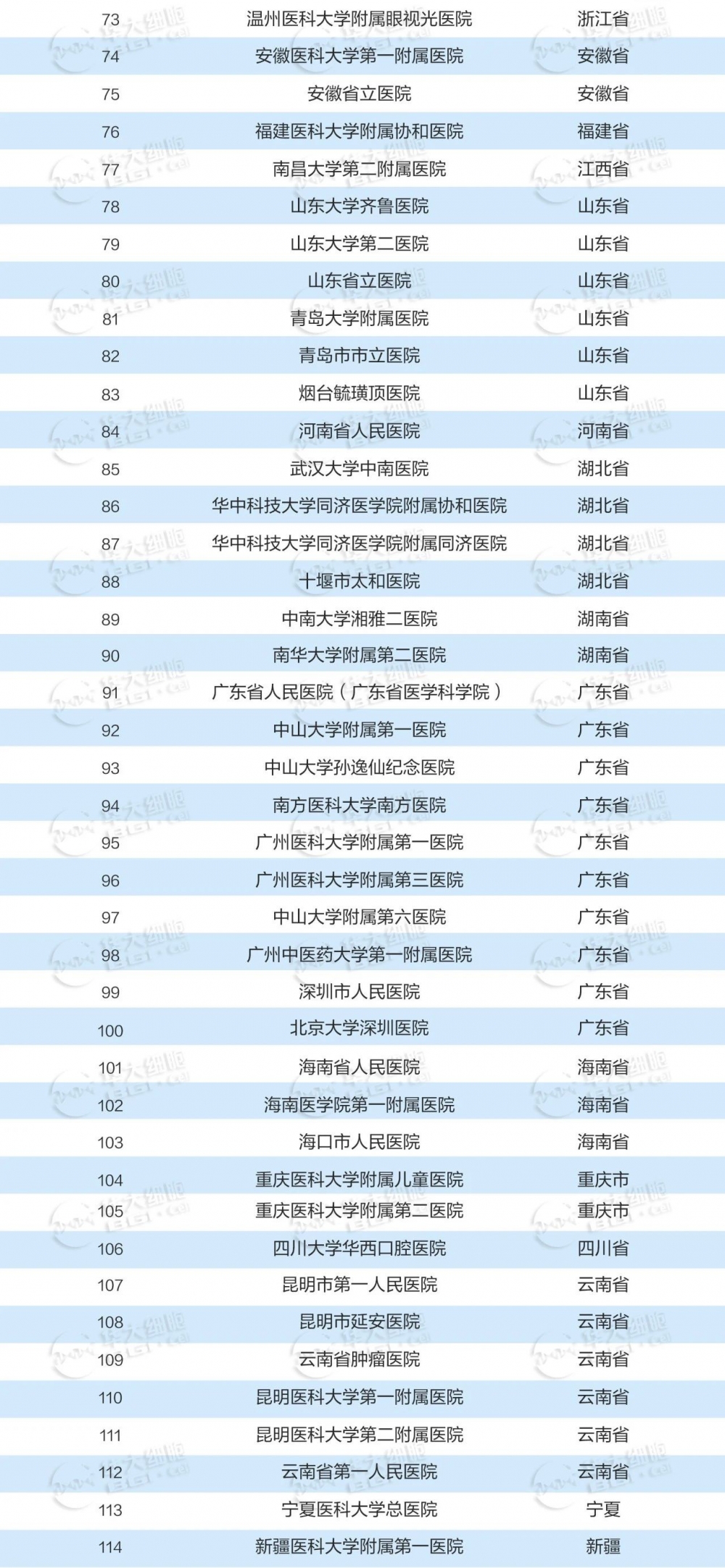
国内干细胞已备案临床研究机构
发布时间:2024-03-29
干细胞技术的研发和治疗技术的推广是实现疾病预防的重要医学手段,国家多个相关部委围绕持续支持行业研究、引入社会资本入场和支持应用转化三大方向陆续颁布一系列扶持政策,为干细胞医疗产业发展提供了良好的政策环境,也因此让我国干细胞行业发展有了全新的速度。
在我国,干细胞按药品、技术管理“类双轨制”监管。企业的干细胞制剂鼓励按药品申报,由国家食品药品监督管理总局(NMPA)监管;医疗机构主导的生物医学新技术,即医院制剂可按医疗技术进行管理,由卫健委监管。
2015年国家卫健委、国家药监局联合发布了《干细胞临床研究管理办法(试行)》。这是我国首个针对干细胞临床研究进行管理的规范性文件,旨在规范干细胞临床研究行为,保障受试者权益,促进干细胞研究健康发展。近年来备案的干细胞临床研究机构也不断增多,共有141家机构完成备案。
干细胞技术被誉为是继药物治疗和手术治疗之后的第三次医学革命,是近年来国际医学前沿重点发展领域,为一些严重及难治性疾病的治疗带来了希望,也受到业界广泛关注。
2023年,国内干细胞领域的发展速度突飞猛进,开启了干细胞药物发展的新篇章。2024年,在产业发展新风向标的指导下,我国干细胞临床转化有望取得更大的突破。未来干细胞发展值得期待!
数据收集截至2023年12月
文章版权归华大细胞所有,未经授权, 禁止转载。
拓展阅读
详情咨询 请致电:400-062-0045


