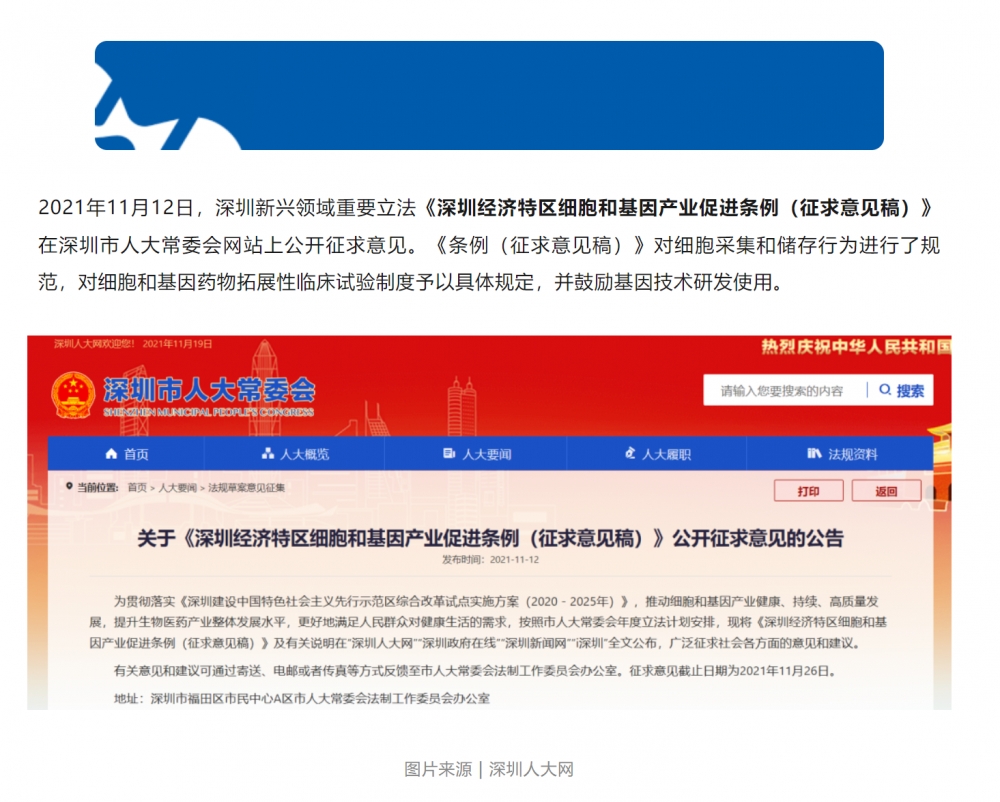
《深圳经济特区细胞和基因产业促进条例(征求意见稿)》发布
发布时间:2021-11-19
 意见稿中明确:
意见稿中明确:
第四章 药物拓展性临床试验
第二十八条 对正在开展临床试验的用于治疗严重危及生命且尚无有效治疗手段疾病的细胞和基因药物,经初步观察可能获益,符合伦理要求的,经审查、知情同意后可以在开展临床试验的医疗机构内用于其他病情相同的患者。细胞和基因药物注册申请人应当按照国家规定申请开展拓展性临床试验。
第二十九条 细胞和基因药物注册申请人完成支持新药品上市注册的临床试验阶段,并且向国家药品监督管理部门提交上市许可申请后,可以开展细胞和基因药物拓展性临床试验。
第三十条 支持细胞和基因药物注册申请人在申请开展细胞和基因药物拓展性临床试验前和试验期间,就存在的问题与国家药品监督管理部门药品审评中心等单位进行沟通交流。市市场监管等部门应当协助建立沟通交流渠道,提供必要的指导与服务。
第三十一条 鼓励细胞和基因药物注册申请人在符合患者意愿和利益的前提下,为患有严重危及生命且尚无有效治疗手段疾病的患者提供拓展性临床试验用细胞和基因药物。拓展性临床试验用细胞和基因药物的安全性数据可以为药品上市提供数据参考。
第三十二条 进行细胞和基因药物拓展性临床试验前,医疗机构、临床试验申办者应当向患者披露可能影响患者作出决定的必要事项,包括使用细胞和基因药物的可能效果、风险、不良反应、救济措施等,并就风险来源、风险后果向患者进行特别提示。患者在理解上述事项的基础上,签署知情同意书。患者属于未成年人、无民事行为能力或者限制民事行为能力人的,医疗机构应当向其监护人披露前款规定事项,并由监护人签署知情同意书。
第三十三条 受试者有权随时退出其参与的细胞和基因药物拓展性临床试验。医疗机构、临床试验申办者应当告知受试者退出后可能存在的风险、不良反应、救济措施等。
第三十四条 有下列情形之一的,应当终止细胞和基因药物拓展性临床试验:(一)细胞和基因药物的临床应用出现严重、非预期的不良反应;(二)细胞和基因药物出现质量问题;(三)细胞和基因药物进一步的临床试验数据不能证明有效性;(四)细胞和基因药物获得国家药品监督管理部门批准上市;(五)其他不符合开展拓展性临床试验的情形。
http://www.szrd.gov.cn/rdyw/fgcayjzj/content/post_742653.html