
盘点 | 全球获得上市批准的细胞治疗产品 ——专题二:干细胞治疗产品
发布时间:2020-04-17
当人体细胞发生病变或组织器官严重衰竭,对生命造成威胁的时候,很多现代医疗手段为人们带来了新的希望。例如在第一期专题中我们曾经介绍过的免疫细胞疗法,为血液系统癌症的治疗开辟了一条崭新的路径(好奇的小伙伴可以戳此了解)。但是克罗恩病等免疫系统疾病还没有有效的治疗方法,用于治疗白血病等血液系统疾病的造血干细胞移植也可能导致严重的并发症,而间充质干细胞可以发挥免疫调节作用,缓解症状。
图片来源 | Pexels
当希望变成失望,救命变成夺命
Luis能否历劫重生?
2005年,11个月大的Luis Fernando Rojo 已经接受了2次脐血移植,3次干细胞注射和一次插管。他有限的生命基本都是在迈阿密大学儿童医院度过的。小Luis患的是先天性骨硬化症,不能形成足够的破骨细胞,他体内过量的骨组织导致了发育畸形、失明和耳聋。虽然骨髓移植或脐血移植可以治疗小Luis的病,但和大多数患者一样,很难找到匹配的捐献者。1月,尽管配型不完全合适,小Luis还是接受了脐血干细胞移植,结果他产生了排斥反应。4月小Luis接受了第二次干细胞移植,之后却发生了越来越严重的皮疹。到了7月,小Luis全身通红,长满水泡,小肠内也开始出血,病情非但没有好转,反而每况愈下。几个月之前,医生曾断言他活下来的可能性只有5%-10%。
小Luis患的是急性移植物抗宿主病(Graft-versus-Host Disease, GVHD),一种影响30%~50%脐血移植或骨髓移植患者的致命并发症。造血干细胞移植后,由于供者的白细胞将受者的组织细胞识别为异体,进而发起攻击,导致皮肤起泡、小肠出血和肝脏衰竭。急性GVHD常常会引起患者多个器官的炎症,而慢性GVHD会影响患者长期存活率和生活质量。尽管有常规的类固醇治疗,但仍有30%~50%的患者没有反应,约80%的儿童患者会在1年内死亡,中位生存期仅有87天[1]。
不幸的是,小Luis就属于这一部分患者。正当Luis的医生,迈阿密大学医学院的儿童免疫学专家Gary Kleiner束手无措之际,美国Osiris公司的Prochymal成为了小Luis最后的希望。Prochymal是治疗成人严重GVHD的一种间充质干细胞药物,正在进行II期临床试验。Dr. Kleiner联系了Osiris公司,请求使用Prochymal救Luis的命。根据同情用药原则,美国FDA在两周之内为Luis进行了紧急特批。
接受Prochymal治疗不到两个星期,Luis的腹泻停止了,皮疹也奇迹般地消失,病情得到了控制。8月份小Luis又接受了另外两次干细胞输注,之后他的情况好转并保持稳定。虽然小Luis还需要一些后续的治疗,但他终于顽强地活了下来。如果没有Prochymal,小Luis是不可能死里逃生的。
Prochymal 图片来源 | michaeljfox
全世界第一款治疗急性儿童GVHD的干细胞药物
全世界第
一款全界
2012年5月17日,加拿大卫生部首先有条件地批准了美国Osiris Therapeutics开发的Prochymal(remestemcel-L)上市。它是加拿大批准的第一个干细胞疗法和治疗GVHD的药物。新西兰随后也同意了Prochymal的上市申请。Prochymal用于治疗类固醇难治性急性GVHD儿童患者。它使用的间充质干细胞来自18至30岁成人捐献的骨髓,经过培养和扩增,可制成多达1万次治疗的剂量,每剂含有7.2×10^7个细胞。Prochymal是冻存状态的现货(off-the-shelf)干细胞治疗产品,可以通过静脉注射直接使用,细胞数量为2百万/kg体重,每周注射2次,连续4个星期。Prochymal于2005年被美国FDA授予孤儿药资格,适应症为GVHD,每剂约20万美元。2013年Prochymal被Osiris转让给澳大利亚的Mesoblast,Mesoblast将Prochymal的商品名改为Ryoncil,并授权日本JCR制药在日本销售(商品名为TEMCELL),2016年2月TEMCELL正式在日本上市,用于治疗急性GVHD,售价为1袋86万日元(约5万人民币),每个疗程8袋。2019年,TEMCELL又被授权治疗大疱性表皮松懈症和新生儿缺氧缺血性脑病。
Ryoncil治疗GVHD 的III期临床试验[NCT02336230]的结果显示,55名儿童患者中有35位病情得到了不同程度的缓解。欧洲一些院校的研究也支持Ryoncil是有效的[2]。最初经过同情用药获得治疗的12位儿童患者两年总生存期达到了40%,而其中的7位得到了完全缓解[3]。在美国和加拿大完成的临床研究[NCT00759018]也表明,Ryoncil大幅提高了严重GVHD儿童患者的28天总缓解率和100天生存率[4]。
2020年2月,Mesoblast公布了Ryoncil的最新临床试验结果,在3个独立研究中,总共有309名急性GVHD儿童患者接受了治疗,其中82%患有最严重的C/D级别的GVHD。Ryoncil显示出良好的安全性和有效性,在接受4周治疗后,204人对治疗反应良好,有反应者的100天和180天生存率分别为84%和83%。今年4月美国FDA接受了Ryoncil的生物制品许可申请(BLA),并授予Ryoncil优先审评资格,预计将于今年9月30日前作出回复。如果审评过程顺利,Ryoncil有望在2020年成为美国第一款获批上市的间充质干细胞产品。

Mesoblast的研发管线 图片来源 | Mesoblast官网
干细胞治疗产品盘点
第
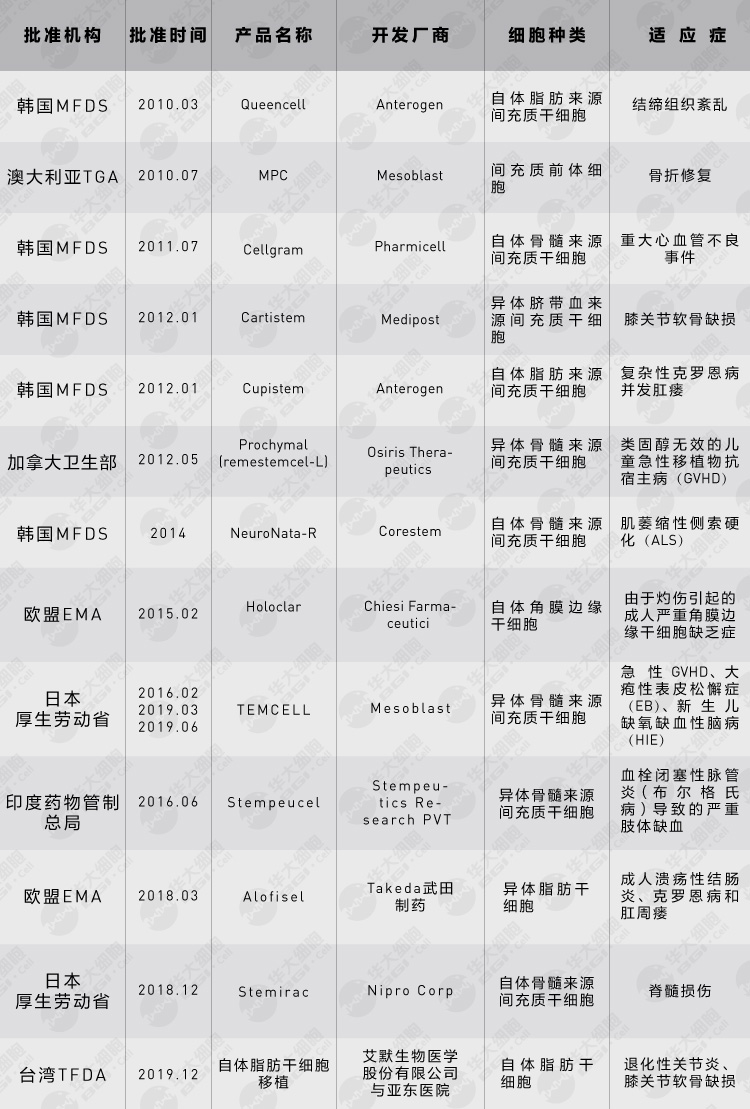
干细胞治疗产品最早于2010年在韩国获批,目前全球共有12种干细胞治疗产品正式获批上市(截至2020年3月,相同产品在不同地区获批,仅统计首次获批),包括11种间充质干细胞产品和1个角膜边缘干细胞治疗产品Holoclar,其中韩国批准了5种。美国FDA尚未批准任何脐带、胎盘、脂肪、皮肤等组织来源间的充质干细胞产品,也没有批准任何诱导多能干细胞(iPSCs)产品或用于心脏、脊髓再生的干细胞疗法。我国大陆地区尚未批准任何一款干细胞治疗产品上市。
孤儿药:治疗罕见病的先锋
孤儿药是指一些专门用于治愈或治疗/控制罕见病的药物。罕见病则指影响范围不到20万人的病症(美国)或是在每2000人(欧盟)或1万人(台湾)中影响不到1人的疾病。由于罕见病患者数量少,新药研发成本高昂,医药公司考虑到利润和投资回报,往往不愿意针对罕见病进行巨额研发投入。因此目前对重大疾病和罕见病的治疗方法还非常有限,大量罕见病患者得不到有效治疗。为了激励罕见病药物的开发,美国FDA和欧盟EMA会对一些符合相应条件的产品适当放宽标准,授予孤儿药资格。自1983年,美国FDA给针对罕见病的研究项目提供绿色通道,加速审批的过程。通常孤儿药最快在完成I期临床试验后就可以给患者使用,同时继续收集数据。在达到常规临床试验标准后,孤儿药有可能会经过再次审批正式上市。已被授予孤儿药资格的细胞治疗产品有数十种,例如CAR-T疗法(CT053、AUTO1、AMG119),异体骨髓来源干细胞产品Multistem,异体诱导多能干细胞(iPSCs)来源 MSCs 疗法Cymerus,异体造血干细胞产品Dilanubicel等。随着越来越多的细胞治疗相关临床试验的陆续开展和完成,未来会有更多新的细胞治疗产品获批上市,为患者提供更丰富的选择。
图片来源 | Pixabay
细胞治疗必须要保证安全性和有效性
细胞治疗产品的安全性和有效性是经过严格设计实施的临床研究充分验证的,产品上市前必须通过国家或地区卫生或药品管理部门的审批。美国FDA注册规定,干细胞治疗须具备安全、有效的证据。大多数干细胞治疗诊所使用的“干细胞”属于药品中的生物药类别,必须获得批准才能为患者使用。在进行临床试验的情况下,由于某些客观条件的限制,例如患者数量非常有限,参与试验的医疗机构仅有一家,治疗方式难以采取随机双盲对照等等,在一些国家和地区开展的细胞治疗并没有严格遵循现行的临床标准,甚至一些地方大量开展的细胞治疗根本没有申报临床试验,导致了某些细胞疗法在安全性和有效性无法得到保证的情况下,就提供给了患者,最终也会损害患者利益。例如美国加州等地多家诊所违规使用干细胞治疗黄斑变性等眼部疾病,由于这些所谓的“干细胞疗法”宣传的适应症范围过于广泛却普遍缺乏科学依据,2019年美国FDA曾向20家干细胞诊所发出警告信,要求这些诊所停止未经证实的、危险的干细胞眼部治疗项目。2019年4月3日,美国FDA发表声明称:FDA将继续阻止诊所和制造商销售未经批准的干细胞产品,同时致力于推动合法的干细胞产品研发。为了保护自身的健康和权益,请选择经过国家批准的正规药物和细胞治疗产品,避免使用或接受不安全、效果无法保证的药物或治疗。

图片来源 | Pixabay
番外篇:造血干细胞治疗产品
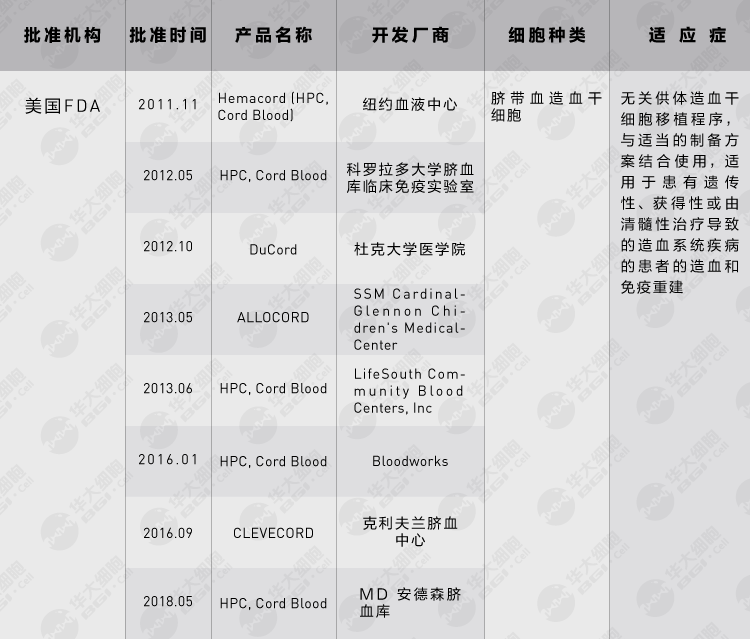
造血干细胞移植是最早应用于临床的干细胞疗法。早在1957年,骨髓造血干细胞移植就被用于治疗严重血液系统疾病。基于HLA鉴定和配型的骨髓造血干细胞移植疗法在70年代逐渐成熟,脐带血干细胞移植也于1988年成功实施。从1957年到2016年,全球共完成近130万例造血干细胞移植,数量正在以每年7%左右的速度增长,2016年全球实施了8.9万例,其中我国有4千多例[5]。由于配型和制备等问题,直到2011年,Hemacord才成为第一个获得美国FDA批准上市的干细胞产品。Hemacord是纽约血液中心开发的脐带血造血干细胞制品,也是全球首个造血干细胞药品。Hemacord无需配型,与适当的制备方案结合使用,适用于患有遗传性、获得性或由清髓性治疗导致的造血系统疾病的患者的造血和免疫重建。

Hemacord 图片来源 | hemacord
造血干细胞治疗产品在美国FDA属于细胞和基因治疗产品类别,截至2020年3月,共有8款脐带血造血干细胞同类产品获批上市,用于治疗例如白血病、遗传性代谢和免疫系统疾病等,进一步丰富了产品种类。
但是根据国家药品监督管理局食品药品审核查验中心发布的《GMP附录-细胞治疗产品》(征求意见稿),造血干细胞产品应该属于“已有规定的造血干细胞移植”,严格来讲造血干细胞不在国家规定的细胞治疗产品范围之内。
前两期专题,分别介绍了免疫细胞治疗产品与干细胞治疗产品,在下一期中, Dr.Wang将继续为大家盘点全球获得上市批准的细胞治疗产品——专题三:组织工程产品,敬请期待。
参考文献
1.Westin, J.R. et al., Steroid-Refractory Acute GVHD: Predictors and Outcomes. Adv Hematol 2011, 601953 (2011) DOI: 10.1155/2011/601953.
2.Galipeau, J., The mesenchymal stromal cells dilemma--does a negative phase III trial of random donor mesenchymal stromal cells in steroid-resistant graft-versus-host disease represent a death knell or a bump in the road? Cytotherapy 15, 2-8 (2013) DOI: 10.1016/j.jcyt.2012.10.002.
3.Prasad, V.K. et al., Efficacy and safety of ex vivo cultured adult human mesenchymal stem cells (Prochymal) in pediatric patients with severe refractory acute graft-versus-host disease in a compassionate use study. Biol Blood Marrow Transplant 17, 534-41 (2011) DOI: 10.1016/j.bbmt.2010.04.014.
4.Kurtzberg, J. et al., Allogeneic human mesenchymal stem cell therapy (remestemcel-L, Prochymal) as a rescue agent for severe refractory acute graft-versus-host disease in pediatric patients. Biol Blood Marrow Transplant 20, 229-35 (2014) DOI: 10.1016/j.bbmt.2013.11.001.
5.Dietger Niederwieser, M. et al., One and Half Million Hematopoietic Stem Cell Transplants (HSCT). Dissemination, Trends and Potential to Improve Activity By Telemedicine from the Worldwide Network for Blood and Marrow Transplantation (WBMT). Blood 134, 2035 (2019) DOI: 10.1182/blood-2019-125232.
6.www.mesoblast.com
7.https://www.fda.gov/home
8.https://www.ema.europa.eu/en
9.https://www.mfds.go.kr/eng/index.do
10.https://cdsco.gov.in/opencms/opencms/en/Home/
11.https://www.tga.gov.au/
12.Amanda Gardner, HealthDay News Oct 14, 2005
13.www.fiercebiotech.com
14.hemacord.info